| back |
水の硬度測定
1 はじめに
硬度1)とは,水に含まれるCa2+とMg2+の量を表す指標であり,この値に基づいて軟水や硬水2)といった水の硬さが決められている。軟水は口当たりがまろやか,硬水は苦みのような口当たりといわれている。近年,スーパーなどで多くの種類のミネラルウォーターを見かけるようになった。採水地が日本である水の多くは,軟水である。一方,採水地がフランスやドイツなどである水の多くは硬水である。どちらの水も,簡単に入手することができる。
ここでは,水の硬度をEDTAという試薬を用いたキレート滴定で測定する方法を紹介する。ただし,操作原理は中和滴定とほとんど同じなので,気軽に,手軽に調べてもらいたい。
2 反応原理
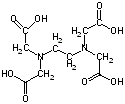
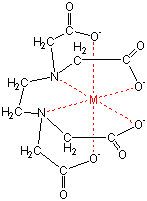
この滴定の原理は,エチレンジアミン四酢酸(ethylendiaminetetraacetic acid,以下EDTA(図1))を用いた金属キレート錯体の形成であり,エリオクロムブラックT(以下EBT)という物質を指示薬として用いる。EBTを用いた滴定では,水中に含まれるCa2+とMg2+の両方の量を知ることができる。pH=10付近の水溶液中でEBTは,青色を呈するが,Ca2+やMg2+との間で錯体を形成すると,赤色を呈する。滴定の反応原理は,以下の説明のとおり(図3)である。
① Ca2+やMg2+が含まれる水にEBTを加えると,EBTと錯体をつくるため,赤色を呈する。
② ここにEDTA水溶液を加えると,Ca2+やMg2+はEBTと錯体をつくるよりも,EDTAとキレート錯体をつくるほうが安定であるため,EDTAのキレート錯体が増加し,EBTの錯体は減少していくので,遊離したEBTは増加する。
③ なお,EDTAのキレート錯体は無色であるので,反応するにつれて溶液の色は,赤色→赤紫色→青紫色→青色へと変化していく。
④ すべて,EDTAのキレート錯体になると,溶液は完全な青色になる。ここが終点である。
⑤ EDTAはCa2+やMg2+とモル比が1:1のキレート錯体を形成するので,滴下したEDTAの量がそのままCa2+とMg2+の量となる。
 |
 |
| 図1 EDTAの分子構造 | 図2 EDTA-金属イオンMのキレート錯体 |
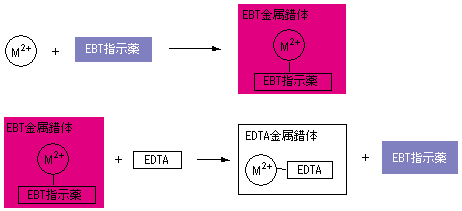 |
| 図3 滴定の原理図 |
実験上の注意
※ アンモニア水を使うため,必ず保護眼鏡を着用すること。また,目や皮膚等に付着しないように気を付け,換気にも配慮して実験を行うこと。
※ ここで紹介している硬度は,全硬度(Ca2+とMg2+の和)のことであり,この測定方法のみを紹介する。カルシウム(Ca2+)のみの硬度を求める実験は,別の試薬を用いることによって測定できる。
| [器具] | ホールピペット(10 mL),メスフラスコ(250 mL),コニカルビーカー(100 mL)×数個, ビュレット(25 mL),ビュレット台,ビーカー(50 mL,100 mL),駒込ピペット,薬さじ,薬包紙,電子天秤 |
| [試薬] | エチレンジアミン四酢酸二ナトリウム二水和物3)(EDTA-Na2・2H2O),エリオクロムブラックT(EBT),硫化ナトリウム(Na2S),濃アンモニア水,塩化アンモニウム(NH4Cl) |
| [検水] | 水道水や市販のミネラルウォーター4)など |
● 試薬の調整
| (1) | 0.0100 mol/L-EDTA水溶液:エチレンジアミン四酢酸二ナトリウム二水和物(EDTA-Na2・2H2O,F.W.=372.24)の結晶を0.931 g量りとり,水に溶かしてメスフラスコで250 mLにする。 |
| (2) | EBT指示薬:エリオクロムブラックT(EBT)0.50 gをメタノールに溶かして100 mLにし,褐色瓶に入れて密栓しておく。 ※ 褐色瓶が手に入らない場合は,無色の瓶でもよいが,保管にはできるだけ遮光すること。 |
| (3) | pH=10緩衝液5):塩化アンモニウム(NH4Cl)6.75 gを濃アンモニア水57 mLに溶かし,水を加えて100 mLとする。 |
| (4) | 5%硫化ナトリウム水溶液6):硫化ナトリウムNa2S 5.0 gを95 gの水に溶かす。 ※ 硫化ナトリウムは潮解性の強い物質である。入手できなければ,省略も可。 |
● 分析の手順
| (1) | ビュレットに,0.0100 mol/L-EDTA水溶液を入れる。 |
| (2) | 検水(水道水やミネラルウォーター等)を20 mL(10 mLホールピペット×2回)はかりとり,100 mLコニカルビーカーに入れる。 |
| (3) | 続いて,pH=10緩衝液を駒込ピペットで2 mL加える。 |
| (4) | さらに,EBT指示薬を駒込ピペットで約0.5 mL滴加える。(図4) ※ 試薬を加えすぎると,色の変化がわかりにくくなるので注意。 ※ 検水中にCa2+やMg2+が存在すれば,ここでは液色が赤色になっている。 |
| (5) | 滴下前のビュレットの目盛りを読む。(図5) |
| (6) | コニカルビーカーを軽く振りながら,ビュレットからEDTA水溶液を滴下する7)。滴下するにつれて,溶液の色は次第に赤みがなくなり,青みがかった紫色になっていく。更に滴下を続けていくと,全く赤みがなくなり,溶液が青色になる。ここが終点である。(図6) |
| (7) | 滴下後のビュレットの目盛りを読む。 |
 |
 |
 |
| 図4 EBT指示薬を入れた直後のビーカー | 図5 滴下前の色の状態 | 図6 滴下後の色の状態 |
|
|
||
| 図7 滴定の様子(動画) |
● 結果の処理
硬度(全硬度,正式にはアメリカ硬度といい,日本ではこれが用いられている。)とは,検水中に含まれるCa2+及びMg2+の量を炭酸カルシウムCaCO3のmg/L(=ppm)に換算した量を指す。EDTA 1 molはCa2+及びMg2+の1 molと反応するので,1 mol/L EDTA ≡ CaCO3 100 g/Lであり,0.0100 mol/L EDTA 1 mL ≡ CaCO3 1.00 mgということになる。
したがって換算公式は,
硬度(mg/L) = 100×(EDTAモル濃度〔mol/L〕)×(EDTA滴下量〔mL〕)×1000÷(検水量〔mL〕)
となる。
例えば,0.0100 mol/LのEDTA水溶液を用いて,検水20.0 mLを滴定したところ,1.30 mL加えたところで反応が完了したならば,硬度
= 100×0.0100×1.30×1000÷20.0 = 65.0 ということになる。
コニカルビーカー内の溶液は,水道の蛇口を開き,流水しながら流しに捨てればよい。このとき,溶液は塩基性であるので,手に触れたり,目に入ったりしないように注意すること。
| (1) | EBT指示薬を加えすぎると,色の変化がわかりにくくなるので注意すること。 |
| (2) | 軟水を滴定する場合,検水の量を増やした方が誤差は小さくなる。一方,硬水の場合,検水の量が多いと,EDTAの消費量が多くなってしまう。 |
7 注釈
| 1) | ここでの硬度は,アメリカでの基準であるアメリカ硬度を指す。現在,日本ではアメリカ硬度を採用している。この基準は,Ca2+及びMg2+の量をCaCO3に換算した,1Lあたりのミリグラム数(mg/L)で表す。 |
| 2) | 世界保健機関(WHO)が決める基準では,硬度120 mg/L未満のものを軟水,120 mg/L以上のものを硬水としている。また,日本で用いられる一般的な指標では,硬度100 mg/L未満のものを軟水,100~300 mg/Lのものを中硬水,300 mg/L以上のものを硬水としている。 |
| 3) | EDTAは,4価の酸であり,H4Yと表記されることもある。H4Yの状態では,水への溶解度が低い。したがって,市販されているEDTAの結晶は,中和されたEDTA二ナトリウム塩Na2H2Yのものがほとんどである。ふつう,EDTAといえば,このEDTA二ナトリウム塩を指す。 |
| 4) | 採水地が日本のものは軟水,フランスやドイツなどヨーロッパ地域のものは硬水であることが多い。2種類以上用意できると,比較できるのでおもしろいのではないか。 |
| 5) | pH=10の条件でEDTA(H4Y)は,,すべて中和して4価の陰イオン(Y4-)になる。4価の陰イオンの状態で,金属イオンとキレートを形成する。 |
| 6) | 硫化ナトリウムは,Fe,Cu,Znなどのイオンのマスキング剤として加える。 |
| 7) | 検水20 mLにつき0.0100 mol/L-EDTA が1 mL消費されたならば,硬度は50 mg/Lである。なお,検水50 mLに対して行うのが正式な滴定法である。 |
8 参考資料
・ 浅田誠一,内出茂,小林基宏著 図解とフローチャートによる定量分析[第ニ版] 技報堂出版
| back |