 |
 |
|
| (写真1) | (写真2) |
| back |
| 水溶液の化学平衡 |
1 目的
| 化学平衡における条件(温度、濃度)の変化が及ぼす影響について、観察、実験を通して理解を深める。 |
2 準備
| [器具] | 試験管、50mLビーカー、200mLビーカー、ガスバーナー、ガラス棒、駒込ピペット、 ナイフ、ピンセット、試験管立て、ろ紙 |
| [薬品] | 塩化コバルト(Ⅱ)、塩化ナトリウム、ナトリウム、純水、氷、沸騰石 |
3 方法
| Ⅰ | コバルト錯体の平衡におよぼす温度効果 | ||||||||||||||
| (1) | 水50mLに塩化コバルト(Ⅱ)を約20g加え、塩化コバルト(Ⅱ)飽和水溶液をつくる(写真1)。
|
||||||||||||||
| (2) | 色の変化を比較するために、飽和水溶液を入れた試験管を2本用意する(写真2)。 |
|
| (3) | 1本の試験管に沸騰石を入れ、撹拌しながらガスバーナーでゆっくり加熱する(動画1)。 | ||||||||||||||
| (4) | 加熱した試験管と加熱していない試験管の色を比較する(写真3)。 | ||||||||||||||
| (5) | なお、加熱した試験管を氷水(200mLビーカー)につけると、もとの赤色にもどる。 | ||||||||||||||
|
|||||||||||||||
| Ⅱ | 飽和食塩水における共通イオン効果 | ||||||||||||||
| (1) | 水50mLに塩化ナトリウムを約15g加え、ガラス棒でよくかき混ぜ、飽和食塩水をつくる。
|
||||||||||||||
| (2) | ナトリウムをろ紙の上に置き、ナイフで切り、米粒大のナトリウムを2つ準備する。 | ||||||||||||||
| (3) | 試験管を2本用意し、一方には飽和食塩水を、もう片方には比較用に純水を入れる(写真4)。 | ||||||||||||||
| (4) | それぞれの試験管にピンセットを用いてナトリウムを入れ、様子を観察する(動画2)。 | ||||||||||||||
|
4 結果・考察
| Ⅰ | コバルト錯体の平衡におよぼす温度効果 |
| (1) | 平衡反応は次のとおりである。 |
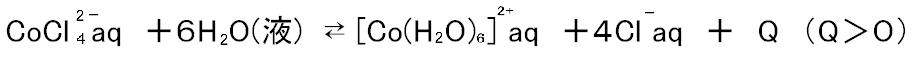 青色 赤色 |
|
| (2) | 加熱すると平衡は左へ移動し、より多くの青色錯体が生成する。冷却すると平衡が右に移動し、赤色の錯イオンが生成する。 |
| Ⅱ | 飽和食塩水における共通イオン効果 |
| (1) | 平衡反応は次のとおりである。 |
| |
|
| (2) | 飽和食塩水にナトリウムを入れると、水と反応し、ナトリウムイオンが増えるため平衡が左に移動し、塩化ナトリウムの結晶が析出する。 |
5 留意点
| (1) | 塩化コバルト(Ⅱ)の溶液は飽和水溶液を用いる。 |
| (2) | 試験管を加熱する際は、突沸しないように、沸騰石を数個入れ、試験管を振りながらゆっくり加熱する。 |
| (3) | 塩化ナトリウムの溶液は飽和水溶液を用いる。 |
| (4) | ナトリウムは手で触らず、ピンセットで扱う。 |
| (5) | ナトリウムは器壁に付着すると発火したり、水に大きな塊を入れると、爆発することがあるので取扱いに気をつける。 |
6 参考文献
○『実験による化学への招待』 (1987),日本化学会 訳編 丸善株式会社,p87-88
○『ダイナミックワイド図説化学』(2008),竹内敬人ほか5名著,東京書籍,p95
| back |