

| back |
化学平衡の分野で学習するルシャトリエの原理には,平衡状態を移動させる条件に,濃度,温度,圧力などがある。ルシャトリエの原理とは,濃度,温度,圧力などを変化させると,その変化を緩和する方向に平衡が移動し,新しい平衡状態になることである。ここでは,コバルト錯体と二酸化窒素を用いた教材として役立つ実験方法を紹介する。
実験上の注意
[試薬・器具]
・塩化コバルト(Ⅱ) ・蒸留水 ・アセトン ・濃塩酸 ・濃硫酸 ・硝酸銀水溶液 ・氷 ・ガスバーナー ・ビーカー(数個) ・試験管(数本)
[試薬調整]
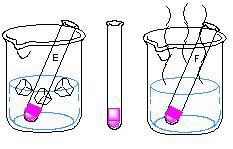
① 塩化コバルト 3.0gを水 30mLに溶解させると,桃色の溶液になる。
② この溶液にアセトンを約 50~60mLを加え,紫色の溶液になるように調整する。
以下,この溶液をコバルト錯体溶液とする。
※ 水の量が多いと薄い赤色を示し,アセトンの量が多いと青色を示す。その中間の紫色になるよう(図1)に調整する。
[実験手順]
(ア) 濃度変化による平衡移動
① コバルト錯体溶液を6本の試験管にそれぞれ約 5 mL取る。
② これら試験管にそれぞれ,水(…試験管A〔H2O濃度増加〕),濃塩酸(…試験管B〔Cl-濃度増加〕),硝酸銀水溶液(…試験管C〔Cl-濃度減少〕),濃硫酸(…試験管D〔H2O濃度減少〕)を数滴ずつ加える。(図2)残った2本はそれぞれ試験管A,BおよびC,Dの比較用として用いる。
③ 各試験管の色を観察し,予想した考えと検討する。
(イ) 温度変化による平衡移動
① コバルト錯体溶液を3本の試験管にそれぞれ約5mLとる。
② 2個のビーカーにそれぞれ氷水と熱水(約 60℃)を半分くらい入れる。
③ コバルト錯体の入った試験管1本は氷水(…試験管E),別の1本は熱水(…試験管F)に浸す。残りの1本はE,Fの比較用として用いる。(図3)
④ 各試験管の色を観察し,予想した考えと検討する。
 |
 |
 |
| 図1 コバルト錯イオン溶液 | 図2 濃度変化による平衡移動 | 図3 温度変化による平衡移動 |
実験上の注意
[試薬・器具]
・銅片(1cm×1cm) ・濃硝酸 ・二また試験管 ・集気瓶 ・ガラス板 ・試験管立て ・水 ・コルクボーラー ・ビーカー×2 ・くぎ×2 ・ゴム栓(No.3)×3 ・シリンジ(樹脂製,20mL)×6 ・ガスバーナー ・ゴム管(Φ3mm) ・気体捕集用の穴あきゴム+ゴム管+ガラス管×2 ・ペーパークリップ×3
[事前準備]
[実験手順]
(ア) 圧力変化による平衡移動
① ふたまた試験管に1枚の銅片を入れ,反対側に濃硝酸を約 5mLとる。
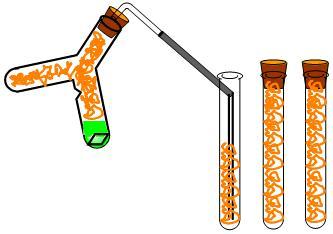
② 図4のように,ゴム管付きのガラス管,ゴム管及びゴム栓を取り付け,銅に濃硝酸を加えて二酸化窒素を発生させる。赤褐色の気体を下方置換にて3本捕集し,ゴム栓をしておく。試験管3本分の気体の量で濃硝酸を戻して発生を止め,それでも発生が続く場合は発生しなくなるまでドラフト内に置いたままにする。
③ ゴム管を取り付けたシリンジを試験管の奥に挿入して,ピストンを引き 15mLずつ二酸化窒素を3本捕集する。(図4)
④ 溝を掘ったゴム栓をシリンジの先端に取り付ける。(図5)
⑤ ゴム栓が飛ばないように注意しながら,シリンジのピストンを押して5mLまで圧縮し,色の濃さの変化を観察する(シリンジA)。圧縮状態でピストンを固定したいときは釘を挿入する。
⑥ 別のシリンジのピストンを引いて 25mLまで膨張させ,色の濃さの変化を観察する(シリンジB)。膨張状態で固定したいときは釘を挿入する。
⑦ 残りの1本はピストンAおよびBの比較用に使う。
(イ) 温度変化による平衡移動
① 3本のシリンジにそれぞれ15 mLずつ二酸化窒素を3本捕集する。(アの実験のシリンジを引き続き用いてもよい。)
② シリンジの先端を上にして,約 15cmに切ったゴム管(Φ3mm)を取り付け,折り曲げてペーパークリップで挟む。(図6)
③ 2個のビーカーにそれぞれ氷水と熱水(約 60℃)を半分くらい入れる。
④ 3本のシリンジのうち1本は氷水(…シリンジC),別の1本は熱水(…シリンジD)に浸す。残りの1本はC,Dの比較用として用いる。
⑤ 各試験管の色を観察し,予想した考えと検討する。
 |
 |
 |
| 図4 二酸化窒素の捕集方法 | 図5 圧力変化用シリンジ | 図6 温度変化用シリンジ |
※ コバルト錯イオンの溶液は金属廃液として回収すること。
※ 二酸化窒素は,ドラフト内で処理すること。やむを得ずドラフトが利用できない場合は,十分な換気を行い,大量の水の中に放出して吸収させること。
(ア) 濃度変化による平衡移動
[Co(H2O)6]2+ + 4Cl-  [CoCl4]2- + 6H2O …①
[CoCl4]2- + 6H2O …①
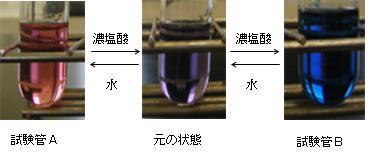
はじめに,H2OとCl-の濃度を高くする実験を行う。紫色のコバルト錯体溶液に水を数滴加えると,溶液の色が薄い赤色(A)になり,濃塩酸を数滴加えると青色(B)に変化する(図7)。このことは,式①の加えた水および塩化物イオンの増加を打ち消す方向に反応が進行していることを説明している。また,Aに濃塩酸を加えると紫色を経て青色に,Bに水を加えていくと紫色を経て赤色に変化していくことから,可逆反応であることも確認できる。
次に,H2OとCl-の濃度を小さくする実験を行う。紫色のコバルト錯体溶液に硝酸銀を加えると塩化銀の白色沈殿が生じるとともに溶液の色が薄い赤色(C)に変化する。系からCl-が取り除かれるため平衡が左に移動してアクア錯体が生成していることが確認できる。また,濃硫酸を数滴加えると青色(D)になった(図8)。これは,濃硫酸が脱水剤として働き,系からH2Oが取り除かれるため平衡が右に移動してクロロ錯体が生成していることが確認できる。
以上のことから平衡状態にある系でH2OとCl-の濃度変化に伴い,溶液の色が変化していくため十分にルシャトリエの原理を確認することができるといえる。ただし,留意点として硝酸銀を加えると塩化銀の沈殿が生成することから系からCl-が除かれること,濃硫酸を加えると脱水作用によりH2Oが除かれることを説明しておく必要がある。また,濃硫酸を加えると溶解熱により温度が上昇することも考慮しておく必要がある。
 |
 |
|
| 図7 コバルト錯体にH2OまたはCl-を加えたときの変化 | 図8 コバルト錯体からH2OまたはCl-を除いたときの変化 |
(イ) 濃度変化による平衡移動
[Co(H2O)6]2+ + 4Cl- = [CoCl4]2- + 6H2O + Q kJ (Q<0) …②
紫色の溶液入った試験管を氷水に浸すと溶液が薄い赤色になり(E),逆に熱水に浸すと青色(F)に変化する。この変化によって式②の正反応が吸熱反応であるため,加熱すると吸熱方向,すなわち正方向に平衡移動してクロロ錯体が生成し,冷却すると発熱方向に平衡移動してアクア錯体が生成することが確認できる。(図9)また,アクア錯体の溶液を加熱するとクロロ錯体が,クロロ錯体の溶液を冷却するとアクア錯体が生成し可逆的な反応であることも確認できる。以上のことから,温度変化による平衡移動は十分に確認できるが,はじめに式②の反応が吸熱反応であることを伝えておく必要がある。
 |
|
| 図9 コバルト錯体を加熱また冷却はしたときの変化 |
(ア) 圧力変化による平衡移動
2NO2 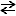 N2O4 …③
N2O4 …③
はじめに,コバルト錯体のように3本のシリンジを並べ色の比較をするのはあまり視覚的な効果は見られない。ここでは,圧縮または膨張させた直後の色の変化を見ておくことが重要である。元の状態から圧縮すると,その瞬間は気体の色が濃くなるが,すぐに薄くなり(図11)ほとんど元の状態と同じ色(A)になる。一方,膨張させると,その瞬間は色が薄くなるが,すぐに色が濃く(図12)なり,これもまたほとんど元の状態と同じ色(B)になる(図10)。これらのことは,圧縮すると分子数が減少する方向すなわち四酸化二窒素が増えるため色が薄くなり,逆に膨張させると分子数が増加する方向すなわち二酸化窒素が増えるため色が濃くなるという現象を説明している。この実験で考慮すべきことは,気体を圧縮または膨張させたときに気体の温度が変化してしまうことである。ただし,その温度変化がちょうど圧力変化の原理説明を妨げないようになっているため,生徒実験としては好都合なのであるが,物理を学習している生徒にとっては疑問に感じることもあるだろうから,その点を留意しておく。
 |
|
| 図10 二酸化窒素を圧縮,膨張させたときの様子 |
| 図11 二酸化窒素を圧縮させたときの様子(動画) | 図12 二酸化窒素を膨張させたときの様子(動画) |
(イ) 温度変化による平衡移動
2NO2 = N2O4 + 57.3 kJ …④
二酸化窒素の入ったシリンジを氷水に浸すと気体の色が薄くなり(C),逆に熱水に浸すと色が濃く(D)なる(図13)。この変化によって,式④の正反応が発熱反応であるため,加熱すると吸熱方向,すなわち逆方向に平衡移動して二酸化窒素の割合が多くなり,冷却すると発熱方向すなわち正方向に平衡移動して四酸化二窒素の割合が多くなることが確認できる。また,CおよびDのシリンジを入れ替えても同様な結果が得られることから,可逆的な反応であることも同時に確認できる。
 |
||
| 図13 二酸化窒素を加熱,冷却させたときの様子 |
コバルト錯体を用いる実験は,赤と青という補色に近い色の変化であるので視覚的にも分かりやすい。手順が単純であるので,しっかり試薬の準備を行っておけば,生徒実験でも少ない時間で済む。留意点としては,アセトンと水を微妙な体積で混和した紫色の溶液を調整しておくことが重要であり,季節によって室温や湿度が異なるので,実験する直前に用意する方がよい。また,この錯体は高等学校の教科書,資料集にほとんど記述されていないので,構造や反応について事前に説明する必要がある。
一方,圧力変化による平衡移動を説明するモデルとして,二酸化窒素を用いる実験が最適である。二酸化窒素は有色であり,四酸化二窒素は無色であるため,色の濃さで認識できるからである。留意点としては,二酸化窒素が有毒で腐食性であるため,必要以上に発生させないこと,ゴム管が腐食するのですぐに洗浄すること,シリンジから漏れないようにしておくことなどが挙げられる。
| back |