| back |
| 寒天ゲルを用いた電気分解 |
1 目的
| 電気分解を行い,陽極,陰極で起こる化学変化を観察することで,酸化還元反応について理解を深める。 |
2 準備
| [器具] | 300mLビーカー,三脚,金網,シャーレ,ワニ口クリップ付きリード線,電池ホルダー(2個),電池(1.5V×2個),ガラス棒,ハサミ(銅板を切るもの),駒込ピペット |
| [薬品] | 寒天,硝酸カリウム,フェノールフタレイン,銅板,アンモニア水(1.0mol/L) |
3 方法
|
(1) |
ビーカーに水200mLを入れ加熱し,それに寒天を5g加えて弱火で加熱し,寒天溶液をつくる。 |
|
(2) |
この寒天溶液を2つに分け,一方に硝酸カリウム1.0gとフェノールフタレインを数滴加える。これを[溶液1]とする。また,寒天溶液のみのものを[溶液2]とする。 |
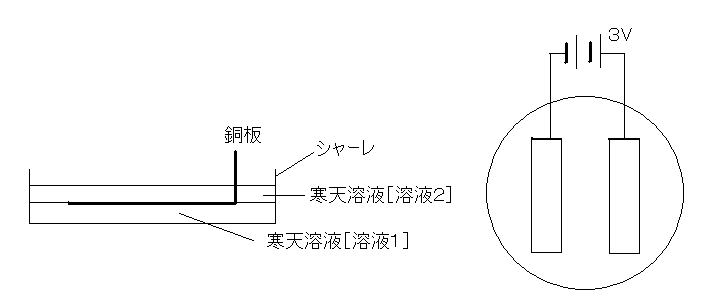
| (3) | シャーレの深さ1/3まで[溶液1]を入れ,固まりかけたところで,銅板(片方の端を1.0cm位折り曲げたもの)を2枚平行に置く。その上に,さらに[溶液2]の寒天溶液を加えて銅板を覆うようにし,しばらく放置する(写真1)。 |
| ※二層にするのは,電気分解後に,(5)の操作でアンモニア水を加えたときに,フェノールフタレインと直接反応しないようにするためと,寒天で銅板を固定するためである(下図)。 | |
 |
|
(4) |
銅板の折れ曲がった先端にそれぞれリード線を付け,約3Vの直流電流を流す(写真2)。このとき両極周辺で起こる変化を観察する(写真3)。 |
| 【陽極】 Cu → Cu2+ + 2e− (酸化) 【陰極】 2H2O + 2e− → 2OH− + H2 (還元) |
|
| (5) | 駒込ピペットを用い,アンモニア水を寒天ゲル表面に加える。このときに起こる変化を観察する(写真4)。 |
 |
 |
| 写真1 | 写真2 |
 |
 |
| 写真3 | 写真4 |
4 結果・考察
| (1) | 寒天溶液に銅板を入れて電気分解を行い観察すると,イオンの拡散速度を抑えることができ,電極周辺で起こる変化を観察しやすくなる。 |
| (2) | 陽極周辺では銅板が溶け,青色に変化し,陰極周辺では赤色に変化することが観察できる(写真3)。陰極周辺を注意深く観察すると,気泡が出ていることが観察できる。また,陽極周辺にアンモニア水を加えると,錯イオン[Cu(NH3)4]2+が生じ,深青色に変化することが観察できる。 |
5 留意点
| (1) | 寒天溶液を作るとき,泡立てないように注意してつくる。 |
| (2) | 寒天溶液を作るとき,皮膚に付けないように注意する。粘性が大きくやけどの危険性がある。 |
| (3) | アンモニアは直接臭いをかがないようにする。 |
| (4) | 電解質として,硝酸カリウムを用いるが,他のハロゲン元素を含まない塩を用いてもよい。 |
| (5) | 寒天の代わりに,ゼラチンを用いてもよい。 |
6 参考文献
『増訂 化学実験事典』 赤堀四郎 木村健二郎 講談社
| back |