|
(1) |
�j�W�}�X�̖���
|
|
|
���ނȂǂ̗⌌�����p�̖����Ƃ��āA�������_���`����p����B����������ꂽ�e��ɖ����܂�����������ėl�q������B�����ŋ��̂����ɂȂ�Ζ����������Ă���B�����܂̔Z�x���Z���ꍇ�A�������S����̂Œ��ӂ���K�v������B
|
|
|
|
|
(2) |
���ːj�̃w�p��������
|
|
|
����P�̂悤�ɒ��ˊ�Ńw�p�������PmL�z�����A�܂����̃w�p�����e��ɂ��ǂ��B���ˊ�̐�[���Ƀw�p���������ʎc���Ă���A����̎����ō̌�����PmL�̌��t�ɑ��āA�\���Ȍ��t�Ìō�p�������B
|
|
|
|
|
|
| ����P |

|
�{�^�����N���b�N�����������B
�f�����J�n�����܂ŁA���炭���҂����������B
|
|
|
|
|
|
|
(3) |
�̌�
|
|
|
�ʐ^�P�E�Q����ѓ���Q�̂悤�ɕ����K�h�㕔����j���h���A�w���ɂ����鏊�܂Œ��Ӑ[���˂����ށB���܂������Ə����s�X�g�������������Ō��t�����R�ɒ��ˊ�ɓ����Ă���B�����Ɉ����Ɨn�����Ă��܂��̂Ō����ώ@�ɂ͎g���Ȃ��B�̌��ł�����A�悭���������ːj���͂����Č��t�������ƕʂ̃o�C�A���r�ɂ����B
|
|
|
| �ʐ^�P |
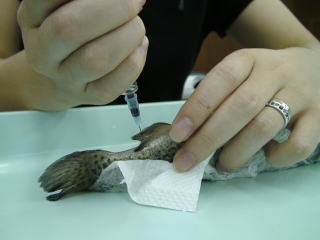 |
�ʐ^�Q |
 |
|
|
|
|
|
|
| ����Q |

|
�{�^�����N���b�N�����������B
�f�����J�n�����܂ŁA���炭���҂����������B
|
|
|
|
|
|
|
(4) |
���t�h���W�{�̍쐬
|
|
|
�̎悵�����t�̏��ʂ��p�X�c�[���s�y�b�g�ŃX���C�h�K���X�̈�[�ɒu���B���̂Ƃ��A���t�̗ʂ������ƌ������m���d�Ȃ肠���Ċώ@�ł��Ȃ��Ȃ�̂Œ��ӂ���B����R�̂悤�ɃJ�o�[�K���X���߂ɂ��Č��t�ɋ߂Â��A�\�ʒ��͂Ō��t���J�o�[�K���X�S�̂ɍL����������̑����Ō��t���X���C�h�K���X��ʂɈ��������B |
|
|
|
|
|
| ����R |

|
�{�^�����N���b�N�����������B
�f�����J�n�����܂ŁA���炭���҂����������B
|
|
|
|
|
|
|
(5) |
�Œ�
|
|
|
�ʐ^�R�̂悤�Ƀh���C���[�Ŋ�����������A���^�m�[���łT���قnjŒ肷��B
|
|
|
|
|
|
| �ʐ^�R |
 |
|
|
|
|
|
|
(6) |
���F
|
|
|
�ʐ^�S�E�T�̂悤�ɃM���U�t�łQ�O�����F����B |
|
|
| �ʐ^�S |
 |
�ʐ^�T |
 |
|
|
|
|
|
(7) |
�����āA������������A�P�O�O�O�{�Ŋώ@����B
|
 �@�@�@
�@�@�@