ヨードホルム反応
1 はじめに
高校化学における有機化合物の構造を推定する実験としてヨードホルム反応がある。ヨードホルムは、水に難溶性で、特有の臭気があるので、比較的簡単にできる実験として定番である。ところが、教科書の手順どおりに行ってみてもうまくいかないことがあり、ここでは失敗なく、手軽に行うことができる方法を紹介する。なお、ヨードホルム反応を示す試薬として、エタノールとアセトンを用いることにする。
2 反応原理
ヨードホルム反応とは、分子内にアセチル基(CH3CO-)あるいは酸化されるとアセチル基を生じる構造(CH3CH(OH)-)を持っていると、塩基性条件下でヨードホルム(化学式CHI3)を生じる反応である。ただし、アセチル基のカルボニル炭素に直接(-OH)が結合しているような分子(たとえば酢酸など)では、この反応は起こらない。
エタノールの場合の反応式 CH3CH2OH + 6NaOH +4I2 → CHI3 + HCOONa + 5NaI + 5H2O
エタノールのヨウ素による酸化の式 CH3CH2OH + 2NaOH +I2 → CH3CHO + 2NaI + 2H2O
アセトンの場合の反応式 CH3COCH3 + 4NaOH + 3I2 → CHI3 + CH3COONa + 3NaI + 3H2O
詳しい反応機構は、以下の図1のとおりである。
- エタノールなど分子中(CH3CH(OH)-R)の部分は、ヨウ素によって酸化されて、アセチル基(CH3CO-R)になる。
- まず、エノール型(CH2=C(OH)-R)の-OH部分の水素原子に塩基(OH-)が作用して、エノラートアニオン(C-H2C=O-R)が生成する。
- 次に、このエノラートアニオンが、ヨウ素(I2)と反応(求核的に攻撃)し、メチル基(-CH3)の水素が1つのヨウ素原子で置換された化合物(CH2IC=O-R)とヨウ化物イオン(I-)になる。
- ケト型では、アセチル基が持つメチル基の水素原子は3つであるが、エノール型ではこれら水素原子のうちの1つがカルボニル基の酸素に結合した構造であるので、もとのメチル基部分の水素原子は2つである。
- 引き続き、2.と3.の反応があと2回おこり、メチル基の水素がすべてヨウ素原子に置換された化合物(CI3C=O-R)と2つのヨウ化物イオンが生成する。
- 4.の化合物はヨウ素原子の誘起効果(電子がヨウ素原子の方へ引き寄せられている)によって、カルボニル炭素の陽性は大きくなっている。このため、塩基(OH-)が作用(求核的に攻撃)して、中間体(CI3CO-(OH)-R)が生成し、これが分解して、トリヨードメチルアニオン(CI3-)とカルボン酸(R-COOH)が生成する。
- 反応が水溶液中の場合は、トリヨードメチルアニオン(CI3-)はカルボン酸の(-OH)から水素原子を引き抜くため、トリヨードメタンすなわちヨードホルム(CHI3)とカルボン酸の陰イオン(R-COO-)となる。
- このように、ヨードホルム反応が塩基性で進行するのは、2.でのエノラートアニオンの安定化、5.でのカルボニル炭素への作用、6.でのカルボン酸の陰イオン
の安定化に塩基(OH-)が重要な役割を果たしているからである。
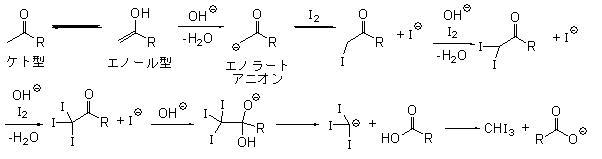 |
| 図1 ヨードホルム反応の機構図 |
3 実験準備
実験上の注意
- 必ず保護眼鏡を着用する。目や皮膚等に付着しないように気を付けること。
- ヨードホルムは、特有の臭気があり、有害性もある。換気に配慮して実験を行うこと。
[器具]
200 mLビーカー、試験管、駒込ピペット、薬さじ、マイクロスパーテル
[薬品]
ヨウ素、ヨウ化カリウム、2mol/L水酸化ナトリウム水溶液、エタノール、アセトン、水
4 実験方法
- 試験管にヨウ素の結晶(およそ各辺 2mmの立方体)をマイクロスパーテルを用いて2〜3欠片(0.1g程度)を入れ、続いてヨウ化カリウムの結晶を薬さじの小さいほうで1〜2杯(0.2〜0.3g程度)を入れる。
- 駒込ピペットを用いて、1.の試験管に水 3mLを加えて溶かし、ヨウ素−ヨウ化カリウム溶液にする。これを2本用意する。(図2)
エタノールの場合
- 駒込ピペットを用いて、2.の試験管にエタノールを2〜3滴(0.2〜0.3mL)加え、60℃の温水で5分程度加熱する。
- 駒込ピペットを用いて、3.の試験管に水酸化ナトリウム水溶液を2〜3滴(0.2〜0.3mL)加えると、ヨウ素の褐色が消える。このあと再び温水で加熱すると、徐々に淡黄色の沈殿が生じてくる。(図2)
アセトンの場合
- 駒込ピペットを用いて、2.の試験管にアセトンを2〜3滴(0.2〜0.3mL)加える。
- 駒込ピペットを用いて、3.の試験管に水酸化ナトリウム水溶液を2〜3滴(0.2〜0.3mL)加えると、ヨウ素の褐色が消えて、淡黄色の沈殿が生じる。(図3)
5 実験の片付け
- 反応溶液は塩基性であるから、適切なpHにしてから下水に流すこと。
- ヨードホルムの沈殿は、ろ過してろ紙に集めて処理すること。あまり、下水に流さないように心掛けること。
6 結果と考察
- エタノールでは、すぐに水酸化ナトリウム水溶液を加えるとヨードホルム反応が起こらない、あるいは生成量が少ない。
- アセトンでは、ヨードホルム反応陽性なアセチル基がはじめから存在しているので、加熱しなくてもすぐに反応がおこる。
- 実験書の中には、水酸化ナトリウム水溶液はヨウ素の褐色が消えるまで加えるとしてあるものがあるが、加えすぎるとヨードホルムの生成量が少ない場合(とくにエタノールを用いたとき)があった。
7 留意点
- ヨウ素−ヨウ化カリウム水溶液の濃度はできるだけ大きいほうがよい。目安としては、光源に透かしても見えない程度がよい。なお、紹介した方法ではヨウ素の溶け残りが生じやすいので、試験管を60℃程度の温水につけてしばらく静置し、完全に溶けてから次の操作を行うこと。
- エタノールでは、水酸化ナトリウム水溶液を加えるまでにしばらく時間を置いたほうがよい。これは、ヨウ素によって酸化された状態をつくるための時間が必要であるからである。これに対しアセトンでは、加熱の必要はない。
- 水酸化ナトリウム水溶液を加えすぎに注意すること。数滴ずつ加え、ヨウ素の褐色が消え始めたら様子をみながら対処するとよい。
8 学習できる内容
- ヨードホルム反応(酸素を含む有機化学物)
- ヨウ素が昇華すること(ヨウ素ヨウ化カリウム溶液を準備する段階)
- ヨウ素はヨウ化カリウム水溶液に溶解すること(ヨウ素ヨウ化カリウム溶液を準備する段階)
9 授業における活用例
- どの化合物がヨードホルム反応をするか、生徒に予想させてから実験を行うと効果的である。
- 次のような実験プリント例を用いて実験を行う。 実験プリント例
10 参考文献
片江安巳、日本化学会編、実験で学ぶ化学の世界3、丸善、1996、p21



